
ヒト由来データの利活用にあたって、中外製薬の「デジタルコンプライアンス」の専門家が取り組んでいること
こんにちは、CHUGAI DIGITALです。
近年、AI、IoT、ロボットやビッグデータ等のデジタル技術の進展を背景に、データが企業の資産として注目されており、中外製薬においてもデジタルトランスフォーメーション(DX)やデータの利活用を推進しています。一方、個人情報保護法の改正やGDPR(一般データ保護規則:EU域内の個人データ保護を規定する法律)の規制強化をはじめとして、データの保護に関する議論も活発です。
こうした状況を踏まえ、新しい種類のデータを適切に利活用するためのあらゆる法令・規制遵守のための活動を中外製薬では「デジタルコンプライアンス」と定義し、体制を整備して戦略的に取り組んでいます。
今回は信頼性保証ユニット 信頼性保証企画部でデジタルコンプライアンスを担当している3名の専門家を取材しました。
01. デジタルコンプライアンスとは?

堀 信義(写真 左)
信頼性保証企画部 デジタルコンプライアンスグループマネジャー
大学での専門は応用生物科学。旧日本ロシュの情報システム部に入社後、研究、コーポレートやインフラなど幅広いシステムの開発運用に従事。ロシュのIT部門に2年間派遣され、最先端のシステムバリデーションを学ぶ。2019年10月より現職。
堀:中外製薬では、デジタルコンプライアンスという言葉を「データ利活用に関わるあらゆる法令・規制遵守のための活動全般」と定義して使っています。以前は「データ保護」と呼んでいましたが、今後のスコープの広がりを見据えて、また、データを提供する人と活用する人の双方がメリットを享受できるデジタル化社会の実現に貢献したいという想いを込めて、デジタルコンプライアンスとしました。社内では短く「デジコン」と呼ばれています。
私たちがいまデジタルコンプライアンスに注力している背景には、データ利活用の環境変化があります。
まず、扱うデータの多用化・膨大化。次世代シークエンサー(Next Generation Sequencer; NGS)により得られるゲノムデータ、ウェアラブルデバイス経由の生体データなど、扱うデータの種類や量が劇的に増えています。次に、個人情報保護法の改正やGDPRなど関連規制の厳格化と、個人データに関する社会的関心の高まりが挙げられます。そして、サイバーセキュリティリスクやレピュテーションリスク等、リスクの多様化も起きています。
02. デジタルコンプライアンスの重要論点:ヒト由来データの取扱い

石西 諒(写真 中央)
信頼性保証企画部 デジタルコンプライアンスG
新卒入社3年目の薬学研究科修士。専門は遺伝子工学。GCPとGVPの品質保証(QA)を担当した後、デジタルコンプライアンスグループの立ち上げメンバーに。現在は研究関連の個別案件相談を担当するほか、ヒト由来データの全社方針策定の一部をリード。
石西:デジタルコンプライアンスの最も重要な論点のひとつが「ヒト由来データ」の取扱いです。「人の健康に関する情報および人体由来の試料から取得されるデータ」を中外製薬ではヒト由来データと呼称しています。
▼ ヒト由来データ
- 人の健康に関する情報
臨床試験や診療で取得される診察、検査、治療、薬剤服用に関するデータ 等
- 人体由来の試料から取得されるデータ
血液・体液・組織・細胞・排泄物等を分析して得られたデータ 等
個人情報保護法において、健康情報は要配慮個人情報としてより厳格な取り扱いが求められているように、ヒト由来データは元となる個人のプライバシー等の権利に影響しうるものとして、慎重に取扱う必要があります。また、ヒト由来データは基本的に元となる個人との同意のもとで取得されているものであり、その同意内容に従った取り扱いが重要です。
ヒト由来データの取扱いに関連する法令や指針は非常に多岐にわたります。日本においては主に個人情報保護法や人を対象とする生命科学・医学系研究に関する倫理指針への対応が必要です。倫理的側面は指針に基づく研究倫理委員会が主管し、対応にあたっています。海外のデータや企業が関連する場合にはGDPRなど、各国の法律にも対応する必要があります。さらに、案件の内容によっては著作権法や不正競争防止法など、個人情報と直接関係しない法律についても、法務部などとも連携しながら対応を検討しています。
▼ ヒト由来データの取扱いに関連する主な法令や指針
① 個人情報保護法
日本の個人情報の保護に関する法令。個人情報の定義及びそれを取り扱う事業者の遵守すべき義務等を規定。
② 次世代医療基盤法
医療分野の研究開発に資するための匿名加工医療情報に関して、作成事業者の認定及び情報の取扱いについて定める法令。
③ 人を対象とする生命科学・医学系研究に関する倫理指針
人を対象とする生命科学・医学系研究に携わる全ての関係者が遵守すべき事項を定めることにより、人間の尊厳及び人権が守られ、研究の適正な推進が図られるようにすることを目的とした倫理指針。「人を対象とする医学系研究に関する倫理指針」と「ヒトゲノム・遺伝子解析研究に関する倫理指針」を統合して制定されたもの。
④ GDPR(EU一般データ保護規則)及び各国法令
EU域内及び海外各国の個人情報の保護に関する法令。
⑤ 臨床研究法
臨床研究・特定臨床研究の実施に関する手続き及び製薬企業の講ずべき措置に関する法令。
⑥ 特許法・著作権法・不正競争防止法 等
特許・著作物・営業秘密等の知的財産の不正使用を防止し保護するための法令。
石西:適用法令や指針、遵守すべき要件はデータの利用目的(医薬品等に関する臨床研究/それ以外の医学的研究/その他)とデータの種別(個人情報/匿名加工(医療)情報/非個人情報)およびデータ取得時の利用目的、紐づく同意や契約によって決まります。
したがって、新たにデータの利活用を進めるためには、まずはデータの入手経緯を整理することから始めます。
治験・臨床試験データやリアルワールドデータ(RWD)など、それぞれのデータがいつ、誰によって、どういった同意や利用目的に基づいて生み出され、中外製薬が入手するに至ったのかを整理することで、利活用のうえで必要となる対応が決まってきます。
また、同じデータであっても国や州によって扱いが異なる場合があります。例えば日本では、ゲノムデータが個人情報に該当する場合があるため注意が必要です。
法令や指針は改定されることがありますので、常に最新情報をフォローすることが必要です。社内だけで判断が難しいときは、社外の弁護士や、研究倫理・医療情報などの研究者にヒアリングを行っています。

大石 哲久(写真 右)
信頼性保証企画部 デジタルコンプライアンスグループ
薬学修士、博士(医学)。専門は薬物動態。中外製薬入社以来30年以上、非臨床・臨床薬物動態、臨床薬理試験の企画、バイオマーカー研究のための試料レポジトリ(バイオバンク)システム構築等に従事。デジタルコンプライアンスの組織化に伴い利活用側から異動。臨床試験に関する個別相談や、ウェアラブルデバイスに関する社内研究ガイドライン策定をリード。
大石:人の命に関わる企業である製薬会社にとって、コンプライアンスはすべての活動の前提となります。当社のトップマネジメントも「企業倫理は業績に優先する」と言い続けています。
デジタルコンプライアンスを推進するにあたり、法令や指針を正しく理解することは出発点で、そこで求められているデータ提供者の権利保護を、データを取り扱うITシステムや、同意取得からはじまる一連のプロセスに反映していくことが大切です。データ提供者の健康情報であるヒト由来データは厳格な取り扱いが求められ、データを保護するための組織的・人的・物理的・技術的安全管理措置を確実に講じています。必要な安全管理措置の具体的内容は、データの種別に社内ガイドラインで細かく規定しています。
個別案件の相談では、ウェアラブルデバイスやスマートフォンで患者さんのデータを取得・解析しビジネスにつなげるようなプロジェクトも扱っており、デバイス、スマートフォン、クラウド、解析環境でのデータのセキュリティとクオリティを確保すべきポイントをひとつずつ確認しています。
最近では、治験・臨床研究データの二次利用に関する相談にも対応しています。治験や臨床研究において、データを提供いただく方(多くは患者さん)から、取得するデータの種類とその利用目的をできる限り特定して、同意をいただかなければなりません。加えて、いただいた貴重なデータを疾患の克服のための研究に幅広く活用できるように、適切に説明文書・同意文書を作成する必要があり、デジタルコンプライアンスグループでもサポートを行っています。
長く中外製薬に勤めていますが、かつてないほどの多様な大量のデータを取得・解析し、それを利用する新しい医療の流れがいま起きているのを実感しています。そこに自分自身も参画し、患者さん中心の医療の実現に貢献していると感じられることが大きなモチベーションになっています。
03. 中外製薬のデジタルコンプライアンス体制の特徴
堀:二人がお話しました通り、デジタルコンプライアンスを推進するためには、全社の知見を蓄積し、アップデートし続け、部門横断的に活用する仕組みが必要です。
そこで当社では、個々のデジタルプロジェクトにともなうコンプライアンス対応をプロジェクト推進やデータ解析を担う各部門の社員だけに任せるのではなく、専門家である私たちが一緒に考え、行動していく体制をつくっています。
私たちが所属するデジタルコンプライアンスグループができたのは、全社のDXを推進するデジタル戦略推進部と同じ2019年10月です。立ち上げにあたり、システム品質保証、セキュリティ、臨床開発、医薬品の品質・安全性管理、研究倫理など多岐にわたる領域で知識と経験を持つメンバーを集めました。様々なバックグラウンドを持つメンバーで構成されているのもデジタル戦略推進部と似ています。
DXの推進とデジタルコンプライアンスは、アクセルとブレーキの関係ではなく、目的地に向かうための車の両輪というイメージです。
デジタルコンプライアンスグループの役割は大きく2つあります。
① 全社方針の策定
全社共通のデジタルコンプライアンス方針を策定。ガイドラインや勉強会の実施などを通して、ガバナンス体制を運用する。
② 個別案件の対応
相談窓口を設置し、全社から寄せられる個別案件のコンサルテーションを行う。コンプライアンスの問題の有無をチェックするだけでなく、解決方法の提案まで行う。
また、データ利活用を行う各部門において「デジタルコンプライアンスオフィサー」を任命し、現場の意見も踏まえて案件の課題整理や全社方針の検討を行う「デジタルコンプライアンス委員会」を組織しています。
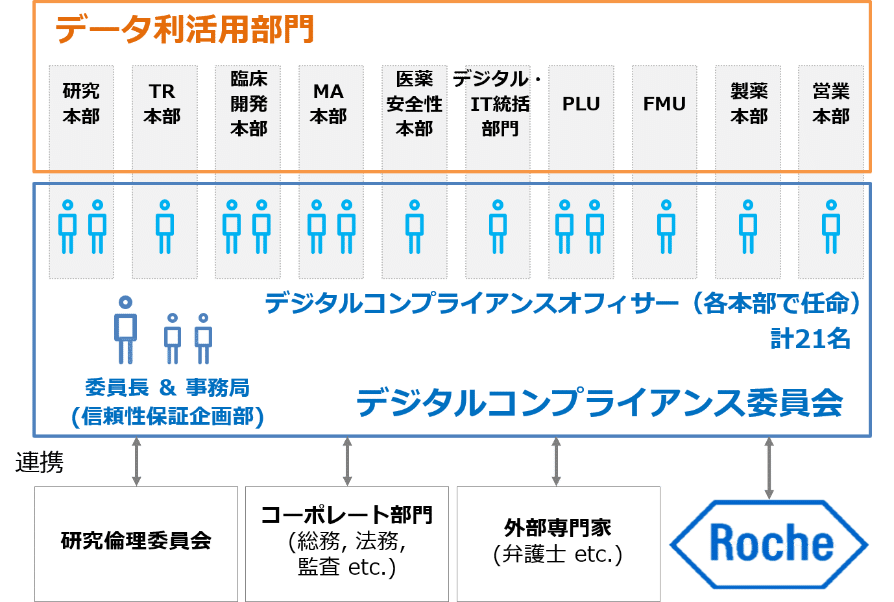
デジタルコンプライアンス推進体制
堀:2020年には150件以上の個別案件に対応しました。今年に入ってもデジタルコンプライアンスのニーズは社内外で高まっています。
石西:全社から幅広く相談を受けており、特に研究本部やデジタル戦略推進部など、研究系の問い合わせが多いです。企画の早い段階から相談を受け、並走することで手戻りを減らすことができます。私は元々研究のサポートがしたくて入社しましたので、スマートな解決方法を示すことが日々のやりがいです。
大石:社内の個別案件の対応が増えているのは担当者として嬉しいことです。一方で、件数が多ければ多いほど良いとは考えていません。我々の知見を現場の担当者と共有し、デジタルコンプライアンスの考えが広く定着することにより、現場判断でよりスピード感をもってプロジェクトを前に進められるようになります。こうした次のフェーズに進むことも意識しながら取り組んでいます。
堀:また今年は、社外のヘルスケア企業やアカデミア、行政とも連携し、業界全体のデジタルコンプライアンスの質を高めていく活動をやっていきたいですね。一企業でできることには限界があり、業界全体で協力していかないと、患者さんにとって価値のあるデータ利活用は進みませんので。一緒にデジタルコンプライアンスを推進していきたいという方は、ぜひご連絡ください。

